“扬子石化杯”
第30届中国化学奥林匹克竞赛(江苏赛区)初赛试卷
可能用到的原子量:
H:1 C:12 N:14 O:16 Na:23 Al:27 Cr:52 Fe:56 Ni:59
Zr:91.2 W:183.8
1.本试卷共22题,用2小时完成,共120 分;
2.用铅笔作答无效;
3.不可使用涂改液或修正带。
一、选择题(本题包括15小题,每小题 4 分,共计 60 分。每小题有 1~2 个选项符合题意。请将答案填在下方的表格内。)
1.4月22日是世界地球日,今年在这个呼唤全体地球人爱护环境的日子,100多个国家代表齐聚联合国,签署应对气候变化的《巴黎协定》,迈出了全球合作保护环境的关键一步。下列有关说法错误的是
A.温室气体达到净零排放是《巴黎协定》的长期目标
B.多开私家车以减轻公共交通压力、减少温室气体的排放
C.要发展太阳能、风能等,减少对化石能源的依赖
D.提倡自带布袋购物,减少一次性塑料袋的使用
2.下列化学用语表示不正确的是
A.NaClO的电子式:![]() B.氯乙烷分子的结构简式: H3C-CH2Cl
B.氯乙烷分子的结构简式: H3C-CH2Cl
C.Mg的结构示意图:![]() D.质子数为7、中子数为8的氮原子:
D.质子数为7、中子数为8的氮原子:![]()
3.用下列有关实验装置进行下列实验,选用仪器和操作都正确的是
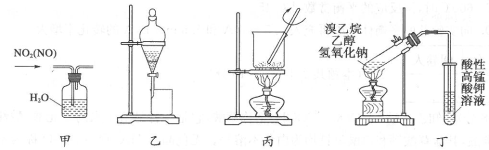
A.用甲装置可除去NO2中的NO
B.用乙装置分离乙酸乙酯和饱和碳酸钠溶液
C.用丙装置将海带灼烧成灰
D.用丁装置验证溴乙烷发生消去反应
4.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.lmol·L-1的NaI溶液中:K+、H+、SO42-、NO3-
B.0.lmol·L-1的FeCl3溶液中:K+、Na+、HCO3-、Cl-
C.0.lmol·L-1的NaHCO3溶液中:K+、Na+、NO3-、Cl-
D.0.lmol·L-1的氨水:Cu2+、Na+、SO42-、NO3-
5.下列有关物质的性质与应用对应关系正确的是
A.二氧化硫有还原性,红酒中加入微量的二氧化硫可抗氧化
B.生石灰能与水反应,可用来干燥氯气
C.过氧化钠具有漂白性,可用于潜水呼吸用氧
D.二氧化硅晶体具有高硬度,可用于制造通讯光缆
6.用NA表示阿伏加德罗常数的值。下列说法正确的是
A.78gNa2O2固体中含有的阴离子数为NA
B.lmo1乙酸和lmo1乙醇充分反应生成的水分子数为NA
C.Fe在氧气中燃烧生成1molFe3O4时,转移的电子数为8NA
D.标准状况下,2.24L己烷含有的分子数为0. lNA
X | Y | Z |
|
W |
|
| T |
7.X、Y、Z、W、T为短周期元素,它们在周期表中的位置如图所示。这五种元素的原子最外层电子数之和为26,下列说法正确的是
A.Y、Z、T三种元素最低价氢化物的沸点依次升高
B.由Y、Z和氢三种元素形成的化合物中只有共价键
C.物质XZ2、WZ2结构不同,但有些化学性质是相似的
D.X元素的单质可以具备导电性,T与X元可素形成化合物XT4
8.下列指定反应的离子方程式书写正确的是
A.NaHCO3溶液中加入醋酸溶液:CO32-+2CH3COOH=CO2↑+2CH3COO-
B.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH-
C.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H=+SO42-=BaSO4↓+2H2O
D.向NH4HSO4中滴加少量的NaOH溶液:NH4++OH-=NH3·H2O+H2O
9.下列物质的转化在给定条件下不能实现的是
A.NH3![]() NO
NO![]() HNO3
HNO3
B.浓HCl![]() Cl2
Cl2![]() 漂白粉
漂白粉
C.Al2O3![]() AlCl3(aq)
AlCl3(aq)![]() 无水AlCl3
无水AlCl3![]() Al
Al
D.淀粉![]() 葡萄糖
葡萄糖![]() C2H5OH
C2H5OH![]() CH3CHO
CH3CHO
10.中国科学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学奖或医学奖。下列有关青蒿素和双氢青蒿素(结构如下图)的说法中不正确的是
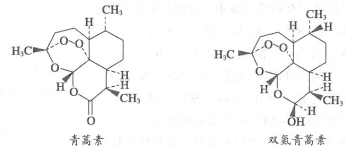
A.青蒿素的分子式为C15H22O5B.由青蒿素制备双氢青蒿素的反应属还原反应
C.青蒿素中含有过氧键、酯基和醚键D.双氢青蒿素中有10种化学环境不同的氢
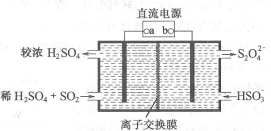 11.利用下图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是
11.利用下图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。下列说法正确的是
A.此装置工作利用了电解的原理
B.阳极的电极反应式为:
SO2+2H2O-2e-=SO42-+4H+
C.阳极的电极反应式为:
2HSO3-+2e-=S2O42-+2OH-
D.其中的离子交换膜需选用阴离子交换膜
12.下列说法正确的是
A.某浓度的氨水加水稀释后pH变小,则其中的c(NH3·H2O)/c(NH4+)的值也减小
B.向AgCl悬浊液中加入少量KI溶液,沉淀转化为黄色,说明Ksp(AgI)>Ksp(AgCl)
C.常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0
D.25℃时,同浓度的Na2CO3溶液的碱性强于C6H5ONa,说明C6H5OH的酸性强于H2CO3
13.根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加盐酸 | 有白色胶状沉淀生成 | 非金属性:Cl>Si |
B | 向MnO2中滴入浓盐酸 | 有黄绿色气体产生 | 氧化性:MnO2>Cl2 |
C | 向A溶液中滴加硝酸,再滴加KSCN溶液 | 溶液变成红色 | A溶液中一定有Fe3+ |
D | 向鸡蛋白溶液中滴入HgCl2溶液 | 有白色沉淀 | 蛋白质发生盐析 |
 14.25℃时,取浓度均为0.1 mol/L的醋酸溶液与氨水各20mL,分别用0.1 mol/L的NaOH溶液、0.1 mol/L 盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如右图所示。下列说法正确的是
14.25℃时,取浓度均为0.1 mol/L的醋酸溶液与氨水各20mL,分别用0.1 mol/L的NaOH溶液、0.1 mol/L 盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如右图所示。下列说法正确的是
A.曲线Ⅰ:滴加溶液到10mL时:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲线Ⅰ:滴加溶液到10mL时:
c(CH3COO-)+c(CH3COOH)=2[c(Na+)+c(H+)]
C.曲线Ⅱ:滴加溶液到20mL时:
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.曲线Ⅱ:滴加溶液时始终存在:
 c(NH4+)+c(H+)=c(Cl-) +c(OH-)
c(NH4+)+c(H+)=c(Cl-) +c(OH-)
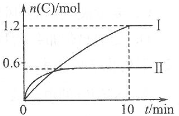
15.在2L的恒容密闭容器中充入A(g)和B(g),发生反应:
A(g)+B(g)![]() 2C(g)+D(s) △H=a kJ/mol实验内容和结果分别如下表和右图所示。下列说法正确的是
2C(g)+D(s) △H=a kJ/mol实验内容和结果分别如下表和右图所示。下列说法正确的是
实验 序号 | 温度 | 起始物质的量 | 热量变化 | |
A | B | |||
Ⅰ | 600℃ | 1mol | 3mol | 96kJ |
Ⅱ | 800℃ | 1.5mol | 0.5mol | - |
A.实验Ⅰ中,10min内平均速率v(B)=0.06mol/(L·min);
B.上述方程式中a=-160
C.600℃时,该反应的平衡常数是0.45
D.向实验Ⅱ的平衡体系中再充入0.5molA和1.5molB,A的转化率增大
二、(本题共2小题,共17分)
16.(8分)已知乙二酸(HOOC-COOH)俗称草酸,它是一种易溶于水的二元酸,酸性强于碳酸,其盐草酸钙和草酸氢钙均为白色不溶物。无色晶体H2C2O4·2H2O称为草酸晶体,其熔点为101.5℃。草酸晶体失去结晶水得无水草酸,它在157℃升华。根据上述信息,回答下列问题:
(1)向盛有2mL饱和NaHCO3溶液的试管里加入少量乙二酸溶液,观察到的现象是 。
(2)向试管A中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸溶液,按下图Ⅰ连接好装置,加热3~5分钟。在装有饱和Na2CO3溶液和试管B中有油状且带有香味的液体产生。B中导管口在液面上而不伸入液面以下的原因是 。写出乙二酸与足量乙醇完全酯化的化学反应方程式: 。
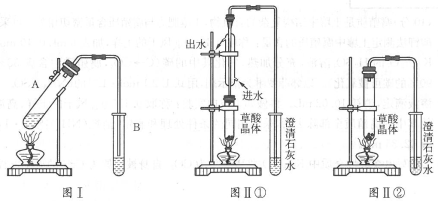
(3)已知草酸分解的化学方程式为:H2C2O4![]() H2O+CO2↑+CO↑。
H2O+CO2↑+CO↑。
利用图Ⅱ①和图Ⅱ②加热草酸晶体,以验证草酸受热是否分解。边疆加热一段时间后的现象是:图Ⅱ①:试管里澄清石灰水先变浑浊,后又变澄清,其原因是 ;图Ⅱ②:试管里澄清石灰水只变浑浊,其原因是 。
(4)能验证草酸受热分解的装置是 (填图Ⅱ中的编号“①”或“②”),理由是 (从装置的特点分析)。
17.(8分)电解饱和食盐水可以得到氯气、氢气和烧碱,传统的方法是使用隔膜将阴阳两极隔开。现代有一种新方法,用离子交换膜法电解食盐水,这种离子交换膜只允许Na+通过。完成下列填空:
(1)用离子交换膜法电解食盐水时,烧碱出现在什么区域? 。
A.阴极 B.阳极
C.两极都有,阴极较多 D.两极都有,阳极较多
(2)传统方法中隔膜的主要作用是分隔开阴阳两极产生的气体,而不能分离溶液中的产品。离子交换膜法中,Na+的移动方向是 。
A.从阴极移向阳极 B.从阳极移向阴极 C.不能确定
与隔膜法相比用离子交换膜法电解食盐水的优点是 。
(3)用离子交换膜法电解食盐水一段时间后,需要在 极(填“阴”或“阳”)区补充 溶液。
(4)氯气是重要的化工原料,可以用来制备很多化工产品,比如可以制备净水剂高铁酸钾,写出碱性条件下,由氯化铁制备高铁酸钾的离子方程式: 。
三、(本题共3小题,共22分)
18.(6分)有一类复合氧化物具有奇特的性质:受热密度不降反升。这类复合氧化物的理想结构属立方晶系,晶胞示意图如右。图中八面体中心是锆(Zr)原子,位于晶胞的顶角和面心;四面体中心是钨(W)原子,共8个,均在晶胞中。八面体和四面体之间通过共用顶点(氧原子)连接。锆和钨的氧化数分别为+4和+6。
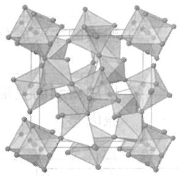 (1)晶胞中锆原子的数目为 。
(1)晶胞中锆原子的数目为 。
(2)该复合氧化物的化学式为 。
(3)已知晶胞参数a=0.916nm,该晶体的密度为
g/cm3。
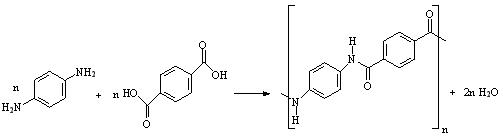
19.(4分)发明开夫拉(Kevler)的波兰裔美国女化学家Stephanie Kwolek 2014年6月18日谢世,享年90岁。开夫拉的强度比钢丝高5倍,用于制防弹衣,也用于制从飞机、装甲车、帆船到手机的多种部件。开夫拉可由对苯二胺和对苯二甲酸缩合而成。
(l)写出用结构简式表达的对苯二胺和对苯二甲酸缩合生成链状高分子的化学方程式:
;
(2)开夫拉高分子链间存在3种主要分子间作用力,请写出其中的两种:
。
20.(12分)兰尼镍(Raney-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,广泛用作烯烃、炔烃等氢化反应的催化剂。其高催化剂活性源于镍本身的催化性质和其多孔结构对氢气的强吸附性。以镍、铝为原料制备兰尼镍的工艺流程如下:
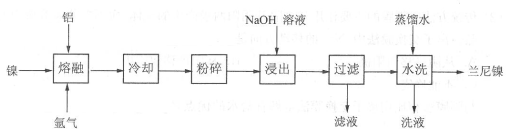
(l)“熔融”时通入氩气的目的是 。
(2)“浸出”是整个流程的核心步骤。
①该步骤的目的是: 。
②发生反应的离子方程式为: 。
③浸出反应所用NaOH溶液的浓度需达5mol/L以上,若用稀NaOH溶液浸出时,则会产生Al(OH)3沉淀阻止浸出持续进行,产生Al(OH)3的化学方程式为:
。
(3)滤液的主要成分与过量CO2反应的离子方程式为: 。
(4)使用新制的兰尼镍进行氢化反应有时不需要加入氢气即可完成反应得到氢化产物,原因是: 。
四、(本题共1小题,共12分)
21.(12分)工业合成有机物F的路线如下:
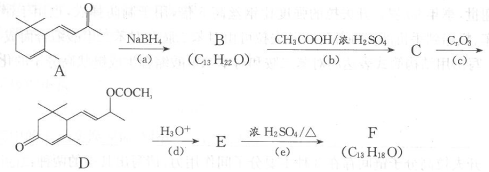
(1)化合物D中有 个手性碳原子;
(2)化合物B、C、E、F的结构简式:
、 、 、 。
(3)上述转化关系中,设计步骤(b)和(d)所达到的目的是:
。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式。
①属于芳香族化合物;②核磁共振氢谱有5种峰;③遇FeCl3溶液显紫色。
。
五、(本题共1小题,共10分)
22.(10分)腐殖质是土壤中结构复杂的有机物,土壤肥力与腐殖质含量密切相关。可采用重铬酸钾法测定土壤中腐殖质的含量:称取0.1500g风干的土样,加入5mL0.10mol/LK2Cr2O7的H2SO4溶液,充分加热,氧化其中的碳(C→CO2,腐殖质中含碳58%,其中90%的碳可被氧化)。以邻菲罗啉为指示剂,用0.1221mol/L的(NH4)2SO4·FeSO4溶液滴定,消耗10.02mL。空白实验如下:上述土壤样品经高温灼烧后,称取同样质量,采用相同的条件处理和滴定,消耗(NH4)2SO4·FeSO4溶液22.35mL。
(l)写出在酸性介质中K2Cr2O7将碳氧化为CO2,自身被还原为Cr3+的离子方程式:
;
(2)写出硫酸亚铁铵滴定过程的离子方程式:
;
(3)上述空白实验中仍然消耗了一定量的K2Cr2O7,原因是 ;
测定实验比空白实验多消耗了K2Cr2O7 mmol,这些K2Cr2O7被用于
。
(4)该土壤中腐殖质的质量分数为 。
“扬子石化杯”第30届中国化学奥林匹克竞赛初赛
参考答案及评分标准
一、选择题(本题包括15小题,每小题 4 分,共计 60 分。)
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
B | CD | B | C | A | AC | CD | C | C | D | AB | AC | B | AD | BD |
二、(本题共2小题,共16分)
16.(8分)
(1)有无色气泡产生(1分)
(2)防止倒吸(或防止B中液体倒吸至A中)(1分)
(3)草酸受热分解产生CO2,CO2使澄清石灰水变浑浊,过量CO2使浑浊又变澄清(1分);由于大量草酸蒸气逸出,与石灰水反应生成草酸钙、草酸氢钙沉淀(1分)
(4)①(1分);增加了冷凝回流装置,避免草酸蒸气逸出(1分)
17.(8分)
(1)A(1分)
(2)B(1分);实现NaOH和NaCl的自动分离(1分),防止发生副反应:Cl2+2NaOH=NaCl+NaClO+H2O(1分);
(3)阳(1分) NaCl(1分)
(4)2Fe3++3Cl2+16OH-=2FeO42-+6Cl-+8H2O(2分)
三、(本题共3小题,共22分)
18.(6分)
(1)4(2分)
(2)ZrW2O8(2分)(写成W2ZrO8,ZrO2·2WO3,2WO3·ZrO2不扣分)
(3)5.07g/cm3
19.(4分)
(1)(2分)
(2)氢键、范德华力、芳环间相互作用(芳环间相互作用也可写成π-π作用或C-H…π作用)(写出任意两种)即可。
20.(12分)
(1)防止Ni、Al被空气氧化(2分)
(2)①除去合金中大部分的铝、形成多孔结构便于吸附氢气(2分)
②2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
③NaAlO2+2H2O=Al(OH)3↓+NaOH(或2Al+6H2O=2 Al(OH)3↓+3H2↑)(2分)
(3)AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(2分)
(4)新制兰尼镍的多孔结构中吸附大量浸出时产生的氢气(2分)
四、(本题共1小题,共12分)
21.(12分)
(1)2(1分)
(2)(每个2分,共8分)

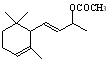
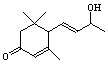
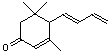
B C E F
(3)保护醇羟基,防止被CrO3氧化(1分)
(4)
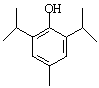 或
或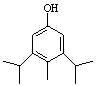 (2分)
(2分)
五、(本题共1小题,共10分)
22.(10分)
(1)2Cr2O72-+3C+16H+=4Cr3++3CO2↑+8H2O(2分)
(2)Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O(2分)
(3)土样中还有除腐殖质外的还原性物质(1分)
0.2509(2分)
氧化腐殖质中的C(1分)
(4)5.8%(2分)
1





 我校学生参加江宁区高中化学实验操作
我校学生参加江宁区高中化学实验操作
 我校学生参加江宁区高中化学实验操作大
我校学生参加江宁区高中化学实验操作大
 苏公网安备32011502010134号
苏公网安备32011502010134号